Tratamento da leishmaniose mucosa com dose baixa de antimoniato de meglumina
- 22 de mar. de 2019

Por Dr. Armando de Oliveira Schubach – A leishmaniose tegumentar americana (LTA) pode ser entendida como um complexo de doenças causadas por diferentes espécies de Leishmania, transmitidas por insetos da família Phlebotominae. A LTA está presente em todos os estados brasileiros e pode afetar a pele (leishmaniose cutânea [LC]) e a mucosas das vias respiratórias e digestivas superiores (leishmaniose mucosa [LM]). Leishmania (Viannia) braziliensis é o agente etiológico mais frequente e mais disperso no território brasileiro, além de ser o principal agente causal da LM na América do Sul.1-3
A LM é uma complicação grave que acomete menos de 5% dos pacientes com LTA.3,4 O antimoniato de meglumina (AM), na dose de 20 mg Sb5+/kg/dia por 30 dias, via intramuscular (IM) ou intravenosa (IV), é recomendado no Brasil como primeira opção para o tratamento da LM, preferencialmente associado a 400 mg de pentoxifilina 3 vezes/dia, em maiores de 11 anos. Para o AM é recomendado o limite máximo de 3 ampolas diárias (1.215 mg Sb5+). Particularmente em pacientes acima de 50 anos, o tratamento costuma ser interrompido temporária ou definitivamente, devido a efeitos adversos mais graves, podendo eventualmente levar a óbito. Portanto, nessa faixa etária, é recomendado o uso de anfotericina B lipossomal como primeira opção terapêutica.3
O Instituto Nacional de Infectologia Evandro Chagas (INI) da Fundação Oswaldo Cruz (Fiocruz), no Rio de Janeiro, é um centro de referência que recebe casos graves e complicados de LTA provenientes de diferentes regiões brasileiras.5 Desde 1989, a equipe médica é composta por dermatologistas, infectologistas e otorrinolaringologistas. Em todas as consultas, as mucosas dos pacientes são avaliadas por videoendoscopia nasal e videolaringoscopia, com endoscópios flexíveis ou rígidos com angulações de 30° ou 70° (marca e origem dos equipamentos: – Storz, Alemanha). Nas últimas três décadas, a dose convencional de 20 mg Sb5+/kg/dia não tem sido utilizada para o tratamento da LTA no INI,5,6 independente do estado brasileiro em que a infecção tenha sido adquirida.7,8 O tratamento com AM na dose de 5 mg Sb5+/kg/dia, de forma contínua ou intermitente (em séries de 10 dias com intervalo de 10 dias de descanso), com máximo de 120 doses, até a epitelização e desinfiltração das lesões mucosas, costuma ser efetivo e bem tolerado pelos pacientes com LM. Consequentemente, não tem sido necessário associar pentoxifilina para aumentar a eficácia ao AM nos pacientes com LM nem adotar a anfotericina B lipossomal como primeira escolha para reduzir o risco de efeitos adversos graves nos pacientes acima de 50 anos.
Entre 1989 e 2004, 1.667 pacientes com LTA foram atendidos no INI, 148 (8,9%) com LM. Destes, 98 (66,2%) foram tratados inicialmente com 5 mg Sb5+/kg/dia ‒ 71 de forma contínua e 27 de forma intermitente. Pacientes acima de 60 anos ou com comorbidades foram selecionados para o esquema intermitente, mais bem tolerado. Dos 98 pacientes, 2 abandonaram o tratamento e 96 permaneceram em acompanhamento. Destes, 76 (79,1%) estavam com as lesões cicatrizadas após o primeiro tratamento com 5 mg Sb5+/kg/dia. Ambos esquemas com 5 mg Sb5+/kg/dia foram bem tolerados, com predominância de efeitos adversos leves ou moderados, levando a interrupção do tratamento em cerca de 5% dos casos e sem ocorrência de óbitos. Todos os 96 pacientes responderam ao tratamento, mesmo quando foram considerados mais um ou dois tratamentos adicionais nos casos de má resposta inicial ou reativação: 88 (91,7%) com 5 mg Sb5+/kg/dia; 2 (2,1%) com 10 a 15 mg Sb5+/kg/dia; e 6 (6,2%) com anfotericina B.9,10
Entre 1998 e 2008, foram estudados 63 pacientes com LM tratados no INI com 5 mg Sb5+/kg/dia, de forma contínua ou intermitente. Os pacientes submetidos ao tratamento em série eram majoritariamente idosos e com mais comorbidades. Ambos os esquemas terapêuticos apresentaram boa efetividade com reduzido número de efeitos adversos. Mesmo nos pacientes com necessidade de retratamento, esses esquemas se mantiveram bem tolerados e eficazes, com 95,2% de sucesso terapêutico.11
Entre 2000 e 2005, uma série de 44 idosos com LTA, entre 60 e 92 anos (mediana 69), incluiu 18 pacientes com LM. O tratamento foi realizado com 5 mg Sb5+/kg/dia, IM, de forma intermitente, até a epitelização e desinfiltração das lesões. Nove dos 44 pacientes necessitaram interromper temporariamente o tratamento, com regressão dos efeitos adversos em todos os casos. Ao final do tratamento, 33 pacientes estavam com as lesões totalmente cicatrizadas. Nos demais 11 pacientes, as lesões residuais regrediram progressivamente nos 3 meses seguintes, sem necessidade de novo tratamento. Três pacientes apresentaram reativação das lesões e responderam bem após a repetição do mesmo esquema terapêutico.12
Entre 2001 e 2013, 777 pacientes com LTA foram tratados no INI, 581 (74,8%) com LC e 196 (25,2%) com LM. Do total de tratamentos realizados, 91,7% foram realizados com AM: 73,1% com 5 mg Sb5+/kg/dia; 12,2% por via intralesional (exclusivamente para LC); e apenas 6,4% com 20 mg Sb5+/kg/dia.5 A maioria dos pacientes no último grupo estava incluída em um ensaio clínico para LC ou LM (em andamento).13 A letalidade foi de 0,1%; a incidência de reativação, 5,8%; e a incidência de LM tardia após o tratamento de LC, 0,25%. Nos 777 pacientes, observou-se ao final: 95,9% cura, 0,1% óbito (um paciente tratado com 20 mg Sb5+/kg/dia) e 4,0% abandono de seguimento.5
Entre 2008 e 2013, 17 pacientes com LM foram tratados com 5 mg Sb5+/kg/dia, IM, de forma contínua até epitelização e desinfiltração das lesões (máximo 120 dias) ou com 20 mg Sb5+/kg/dia durante 30 dias. Doze pacientes com idade de 52 ± 13,4 anos concluíram o tratamento com as lesões cicatrizadas, enquanto 5 pacientes com idade 68,4 ± 7,34 anos (p=0,022) necessitaram interromper o tratamento (3 tratados com 20 mg Sb5+/kg/dia e 2 tratados com 5 mg Sb5+/kg/dia) por efeitos adversos. Dois desses 5 pacientes foram tratados com sucesso com anfotericina B lipossomal, conforme a recomendação atual.3 Os outros três pacientes foram tratados com sucesso com AM 5 mg Sb5+/kg/dia, IM, de forma intermitente (em séries de 10 dias, com intervalos de 10 dias de descanso), até a epitelização e desinfiltração das lesões.14 Outros autores sugeriram que o uso de AM em doses baixas, de forma intermitente, por um tempo prolongado até a cura, poderia ser eficaz em pacientes com LM e com resposta insatisfatória ao tratamento inicial.15,16
Em 2017, o Ministério da Saúde (MS) reconheceu que esquemas terapêuticos com 5 mg Sb5+/kg/dia por 30 dias, de forma contínua ou intermitente, poderiam ser utilizados em outras regiões do país quando o uso de 20 mg Sb5+/kg/dia fosse um risco para os pacientes. Entretanto, ressaltou-se que os estudos foram desenvolvidos com pacientes infectados com os genótipos de Leishmania sp. circulantes no estado do Rio de Janeiro.3
Estudo recente comparou a resposta ao tratamento com 5 mg Sb5+/kg/dia em dois grupos de pacientes, com infecção adquirida no estado do Rio de Janeiro ou em outros estados (OE). Após um curso de 5 mg Sb5+/kg/dia, 66,6% dos 27 pacientes com LM (50% no grupo RJ e 80% no grupo OE) tinham lesões cicatrizadas. Após um ou dois tratamentos adicionais com o mesmo esquema terapêutico, 85,2% dos pacientes com LM estavam com as lesões cicatrizadas. Efeitos adversos foram observados em 58% dos pacientes no grupo RJ e em 80% no grupo OE. Não foram observadas diferenças significativas nas taxas de cura nem de efeitos adversos entre os grupos RJ e OE. Nenhum paciente necessitou interromper definitivamente o tratamento devido a eventos adversos.8
Apesar da experiência satisfatória dos esquemas terapêuticos alternativos com AM no Rio de Janeiro e da aceitação do seu uso pelo MS, tais esquemas não têm sido adotados em outras regiões brasileiras. A indicação de doses altas de Sb5+ baseia-se na crença de que o uso de subdoses poderia resultar em resistência ao tratamento antimonial ou ser um fator de risco para o desenvolvimento de LM.4,17,18 Em estudos anteriores, foram avaliados o polimorfismo genético e a sensibilidade in vitro de isolados de L. (V.) braziliensis obtidos de pacientes com LC, antes do tratamento com AM (5 mg Sb5+/kg/dia ou intralesional) e após a reativação ou resposta terapêutica inicial inadequada. Esses trabalhos não suportam a hipótese de que o tratamento com 5 mg Sb5+/kg/dia poderia induzir a seleção de cepas clinicamente resistentes ao tratamento antimonial.19-21 Além da baixa incidência de LM tardia após o tratamento de LC no INI, foram compilados os estudos que revelam a boa experiência com o uso de 5 mg Sb5+/kg/dia para o tratamento da LM.5
A resposta favorável a tratamentos prolongados para LC costuma ser questionada e, eventualmente, atribuída à cura espontânea. Entretanto, alguns estudos sugerem a ocorrência de baixas taxas de cura espontânea após ausência de tratamento ou uso de placebo, particularmente na infecção por L. (V.) braziliensis.22,23 Adicionalmente, a evolução para cura espontânea não é um evento esperado na LM.3,4
Outra questão é se tratamentos prolongados poderiam influenciar negativamente na adesão dos pacientes ao tratamento. Entre 2001 e 2013, apenas 4% dos 777 pacientes tratados no INI abandonaram o tratamento.5 Um estudo encontrou uma associação significativa entre maior adesão ao tratamento e o uso de 5 mg Sb5+/kg/dia.24 Alguns autores relatam que um esquema de tratamento intermitente com AM (mais longo que o esquema padrão) esteve associado a menor frequência de abandono do tratamento e de perda do seguimento.25
No Brasil, o tratamento da LTA geralmente ocorre em unidades de atenção primária à saúde, as quais dispõem de recursos limitados e dificuldades na administração e no monitoramento de efeitos adversos de medicamentos como a anfotericina B, assim como no manejo de comorbidades. Adicionalmente, as unidades de saúde secundárias ou terciárias geralmente são afastadas das residências dos pacientes, frequentemente em outras cidades, implicando em dificuldade de acesso a esse tratamento.26
Os resultados mostrados sugerem que pacientes com LM, particularmente idosos, poderiam se beneficiar do tratamento com 5 mg Sb5+/kg/dia de forma intermitente (em séries de 10 dias, com intervalo de 10 dias de descanso), até a epitelização e desinfiltração das lesões.
Figura 1. Leishmaniose mucosa. Epiglote infiltrada e hiperemiada. Infiltração granulosa grosseira em prega ariepiglótica e laringe.
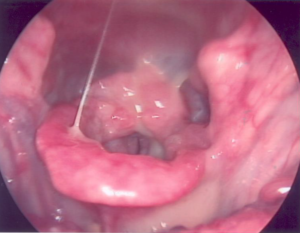
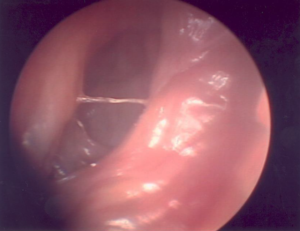
Figura 2. Leishmaniose mucosa. Fossa nasal com infiltração, hiperemia e crostas finas.
Créditos das imagens: Acervo pessoal, Dra. Claudia Maria Valete Rosalino.
Referências bibliográficas
- Word Health Organization. Control of the leishmaniasis: report of a meeting of the WHO Expert Committee on the Control of Leishmaniases [Internet]. WHO technical report series No. 949. Geneva: WHO; 2010. [Acesso em 1 fev 2019]. Disponível em: http://www.who.int/neglected_diseases/integrated_media/integrated_media_2010_leishmaniasis_2/en/
- Organización Panamericana de la Salud. Leishmaniases en las Américas: recomendaciones para el tratamiento. Washington, DC: OPAS; 2013.
- Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Vigilância das Doenças Transmissíveis. Manual de Vigilância da Leishmaniose Tegumentar [Internet]. Brasília: SVS/MS; 2017. [Acesso em 1 fev 2019]. Disponível em: http://www.dive.sc.gov.br/conteudos/publicacoes/17_0093_M_e_C.pdf.
- Blum J, Lockwood DN, Visser L, Harms G, Bailey MS, Caumes E, et al. Local or systemic treatment for New World cutaneous leishmaniasis? Re-evaluating the evidence for the risk of mucosal leishmaniasis. Int Health. 2012;4(3):153-63.
- Brahim LR, Valete-Rosalino CM, Antônio LF, Pimentel MIF, Lyra MR, Paes LEC, et al. Low dose systemic or intralesional meglumine antimoniate for American tegumentary leishmaniasis results in low lethality, low incidence of relapses, and low late mucosal involvement in a referral centre in Rio de Janeiro, Brazil (2001-2013). Mem Inst Oswaldo Cruz. 2017;112(12):838-43.
- Schubach AO, Conceição-Silva F. Estado da arte no tratamento da leishmaniose tegumentar americana no Brasil. In: Conceição-Silva F, Alves CA. Leishmanioses do continente americano. Rio de Janeiro: Editora FIOCRUZ; 2014. p. 391-412.
- Antônio LF, Fagundes A, Oliveira R, Pinto P, Vasconcellos EFC, Bedoya-Pacheco SJ, et al. Montenegro skin test and age of skin lesion as predictors of treatment failure in cutaneous leishmaniasis. Rev Inst Med Trop São Paulo. 2014;56(5):375-80.
- Cataldo JI, Conceição-Silva F, Antônio LF, Schubach AO, Marzochi MCA, Valete-Rosalino CM, et al. Favorable responses to treatment with 5 mg Sbv/kg/day meglumine antimoniate in patients with American tegumentary leishmaniasis acquired in different Brazilian regions. Rev Soc Bras Med Trop. 2018;51(6):769-80.
- Meneses AM. Perfil epidemiológico, clínico e terapêutico dos pacientes com a forma mucosa de leishmaniose tegumentar americana, atendidos no Instituto de Pesquisa Clínica Evandro Chagas – Fundação Oswaldo Cruz, Rio de Janeiro, no período de 1989 a 2004 [dissertação de mestrado]. Rio de Janeiro: Instituto de Pesquisa Clínica Evandro Chagas, Fundação Oswaldo Cruz; 2007.
- Moreira JS. Tratamento das lesões mucosas das vias aéreas e digestivas superiores de pacientes com leishmaniose tegumentar americana com doses baixas de antimoniato de meglumina (5 mg Sb5+/kg/dia) [tese de doutorado]. Rio de Janeiro Instituto de Pesquisa Clínica Evandro Chagas, Fundação Oswaldo Cruz;
- Melgares MCV. Efetividade e segurança do antimoniato de meglumina nos esquemas contínuo e intermitente com dose baixa (5 mg Sb5+/kg/dia) no tratamento da leishmaniose mucosa [dissertação de mestrado]. Rio de Janeiro: Instituto de Pesquisa Clínica Evandro Chagas, Fundação Oswaldo Cruz; 2012.
- Vasconcellos EFC, de Oliveira Schubach A, Valete-Rosalino CM, de Souza Coutinho R, Conceição-Silva F, de Matos Salgueiro M, et al. American tegumentary leishmaniasis in older adults: 44 cases treated with an intermittent low-dose antimonial schedule in Rio de Janeiro, Brazil. J Am Geriatr Soc. 2010;58(3):614-6.
- Saheki MN, Lyra MR, Bedoya-Pacheco SJ, Antônio LF, Pimentel MIF, Salgueiro MM, et al. Low versus high dose of antimony for American cutaneous leishmaniasis: a randomized blind non-inferiority trial in Rio de Janeiro, Brazil. PLoS ONE. 2017;12(5):e0178592.
- Terceiro BRF. Opções terapêuticas na leishmaniose mucosa [tese de doutorado] Rio de Janeiro: Instituto de Pesquisa Clínica Evandro Chagas, Fundação Oswaldo Cruz; 2018.
- Oliveira-Neto MP, Mattos M, Pirmez C, Fernandes O, Gonçalves-Costa SC, Souza CFS, et al. Mucosal leishmaniasis (“espundia”) responsive to low dose of N-methyl glucamine (Glucantime) in Rio de Janeiro, Brazil. Rev Inst Med Trop São Paulo. 2000;42(6):321-5.
- Oliveira-Neto MP, Mattos MS. Successful therapeutic response of resistant cases of mucocutaneous leishmaniasis to a very low dose of antimony. Rev Soc Bras Med Trop. 2006;39(4):376-8.
- Grogl M, Thomason TN, Franke ED. Drug resistance in leishmaniasis: Its implications in systemic chemotherapy of cutaneous and mucocutaneous disease. Am J Trop Med Hyg. 1992;47:117-26.
- Herwaldt BL, Berman JD. Recommendations for treating leishmaniasis with sodium stibogluconate (Pentostam) and review of pertinent clinical studies. Am J Trop Med Hyg. 1992;46:296-306.
- Baptista C, Schubach AO, Madeira MF, Miranda LFC, Pinto AGS, Barros JHS, et al. Evaluation of genetic polymorphism of Leishmania (V.) braziliensis isolates obtained from the same patient before and after therapeutic failure or reactivation of cutaneous lesions. J Trop Med. 2012; Article ID 808132.
- Baptista C, Miranda LFC, Madeira MF, Leon LLP, Conceição-Silva F, Schubach AO. In vitro sensitivity of paired Leishmania (Viannia) braziliensis samples isolated before meglumine antimoniate treatment and after treatment failure or reactivation of cutaneous leishmaniasis. Disease Markers. 2015; Article ID 943236.
- Gagini T, Schubach AO, Madeira MF, Valete-Rosalino CM, Pimentel MIF, Pacheco RS. Genotypic profiles of Leishmania (Viannia) braziliensis strains from cutaneous leishmaniasis patients and their relationship with the response to meglumine antimoniate treatment: a pilot study. Parasite. 2017;24:34.
- Cota GF, de Sousa MR, Fereguetti TO, Saleme PS, Alvarisa TK, Rabello A. The cure rate after placebo or no therapy in american cutaneous leishmaniasis: a systematic review and meta-analysis. PLoS ONE. 2016;11(2):e0149697.
- Oliveira-Ribeiro C, Pimentel MIF, Oliveira RVC, Fagundes A, Madeira MF, Mello CX, et al. Clinical and laboratory profiles of patients with early spontaneous healing in cutaneous localized leishmaniasis: a historical cohort study. BMC Infect Dis. 2017;17:1-8.
- Ribeiro MN, Pimentel MI, Schubach AO, Oliveira RV, Teixeira JL, Leite MP, et al. Factors associated to adherence to different treatment schemes with meglumine antimoniate in a clinical trial for cutaneous leishmaniasis. Rev Inst Med Trop São Paulo. 2014;56(4):291-6.
- Azeredo-Coutinho RBG, Mendonça SCF. An intermittent schedule is better than continuous regimen of antimonial therapy for cutaneous leishmaniasis in the municipality of Rio de Janeiro, Brazil. Rev Soc Bras Med Trop. 2002;35(5):477-81.
- Duque COM, Quintão JJ, Gonçalves LF, Gomes C, Almeida HL, Silveira ES, et al. Treatment of cutaneous leishmaniasis with intralesional meglumine antimoniate at a primary care unit in Brazil. Rev Med Sau Brasília. 2017;6(2):240-8.
Colaboraram:
– Andréa Morais de Meneses. Médica otorrinolaringologista, Mestre em Pesquisa Clínica em Doenças Infecciosas pelo INI/Fiocruz.
– Benivaldo Ramos Ferreira Terceiro. Médico otorrinolaringologista, Doutor em Pesquisa Clínica em Doenças Infecciosas pelo INI/Fiocruz.
– Carla Oliveira Ribeiro. Médica dermatologista, Mestre em Pesquisa Clínica em Doenças Infecciosas pelo INI/Fiocruz, Médica dermatologista do Centro de Medula Óssea (CEMO) do Instituto Nacional do Câncer (Inca).
– Cláudia Maria Valete-Rosalino. Médica otorrinolaringologista, Doutora em Saúde Pública pela Escola Nacional de Saúde Pública Sérgio Arouca/Fiocruz, Pesquisadora do INI/Fiocruz, Professora do Departamento de Otorrinolaringologia e Oftalmologia/Universidade Federal do Rio de Janeiro (UFRJ).
– Cibele Baptista. Médica veterinária, Doutora em Pesquisa Clínica em Doenças Infecciosas pelo INI/Fiocruz, Analista de Inovação e Operação Farmacêutica do Instituto de Tecnologia em Imunobiológicos (Bio-Manguinhos)/Fiocruz.
– Érica Ferreira Camargo de Vasconcellos. Médica dermatologista, Doutora em Pesquisa Clínica em Doenças Infecciosas pelo INI/Fiocruz, Professora da Faculdade Souza Marques.
– Jamyra Iglesias Cataldo. Biomédica, Doutora em Pesquisa Clínica em Doenças Infecciosas pelo INI/Fiocruz, Professora da Escola Técnica Complemento.
– João Soares Moreira. Médico otorrinolaringologista, Doutor em Pesquisa Clínica em Doenças Infecciosas pelo INI/Fiocruz, Pesquisador do INI/Fiocruz.
– Lucia Regina do Nascimento Brahim. Bióloga, Doutora em Pesquisa Clínica em Doenças Infecciosas pelo INI/Fiocruz.
– Madelon Novato Ribeiro. Farmacêutica, Mestre em Pesquisa Clínica pelo INI/Fiocruz, Doutoranda em Pesquisa Clínica em Doenças Infecciosas pelo INI/Fiocruz, Farmacêutica Clínica no Hospital Universitário Gaffré e Guinle/Universidade Federal do Estado do Rio de Janeiro (UNIRIO).
– Maria Cristina de Oliveira Duque. Médica dermatologista, Mestre em Pesquisa Clínica pelo INI/Fiocruz.
– Maria Inês Fernandes Pimentel. Médica dermatologista, Doutora em Medicina (Dermatologia) pela Universidade Federal do Rio de Janeiro (UFRJ), Pesquisadora do INI/Fiocruz, Médica da Vigilância Epidemiológica da Secretaria de Estado de Saúde do Rio de Janeiro.
– Marcelo Rosandiski Lyra. Médico dermatologista, Doutor em Pesquisa Clínica em Doenças Infecciosas pelo INI/Fiocruz, Pesquisador do INI/Fiocruz.
– Maurício Naoto Saheki. Médico infectologista, Mestre em Pesquisa Clínica em Doenças Infecciosas pelo INI/Fiocruz, Pesquisador do INI/Fiocruz.
Mirian Catherine Vargas Melgares. Médica otorrinolaringologista, Mestre em Pesquisa Clínica em Doenças Infecciosas pelo INI/Fiocruz.
– Sergio Roberto Mortari. Químico, Doutor em Química Analítica pela Pontifícia Universidade Católica do Rio de Janeiro (PUC-Rio), Professor Adjunto III do Centro Universitário Franciscano (Santa Maria, RS).
– Thalita Gagini Braga. Bióloga, Doutora em Pesquisa Clínica em Doenças Infecciosas pelo INI/Fiocruz.
Conheça nosso curso completo de atualização em infectologia:
Curso de Atualização em Infectologia (5 Módulos)










